
Arbeitsgruppe Möller
Forschungsschwerpunkte
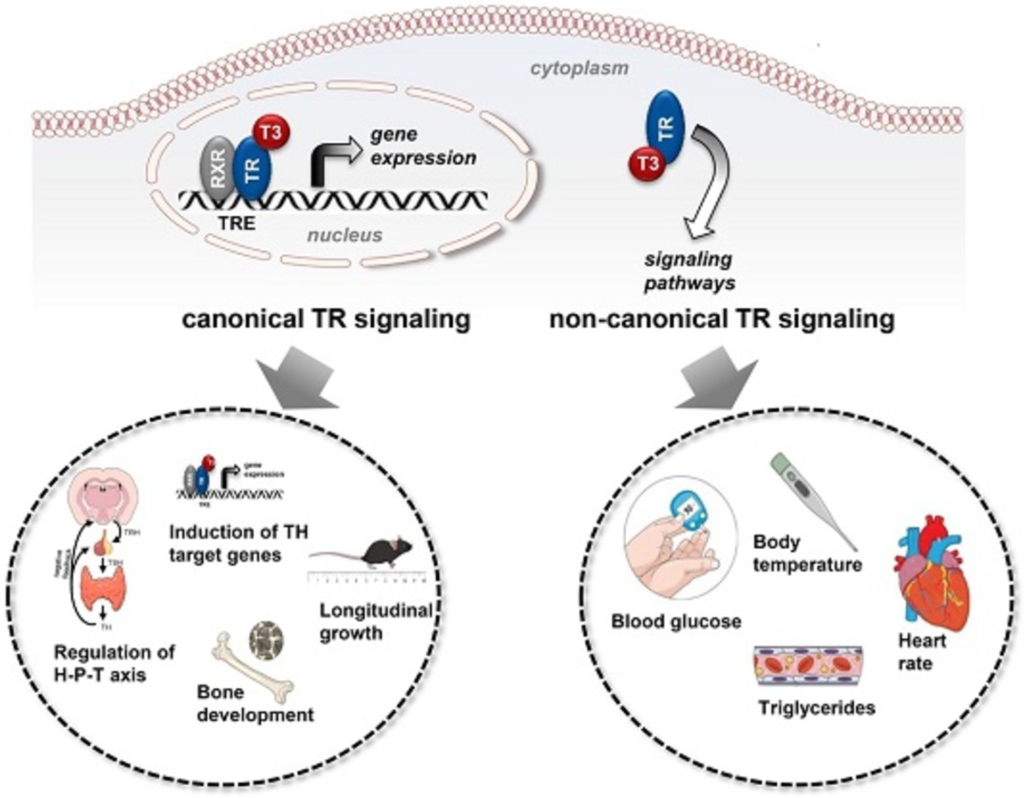
Schilddrüsenhormonwirkung
- Aufklärung der zellulären Wirkmechanismen von TRα und TRβ
- Physiologische Bedeutung der kanonischen und nicht-kanonischen Wirkung von TRα und TRβ
Schilddrüsenhormone (TH) regulieren eine Vielzahl von physiologischen Prozessen wie z.B. die Körpertemperatur, den Herzschlag, das Wachstum sowie auch den Glukose- und Lipidstoffwechsel. Die TH-Wirkung in den jeweiligen Zielorganen wird durch die Schilddrüsenhormonrezeptoren TRα und TRβ vermittelt. Klassischerweise fungieren die Rezeptoren als Transkriptionsfaktoren und regulieren nach Ligandenbindung die Genexpression. Neben der Genregulation existiert noch ein zusätzlicher, nicht-kanonischer Wirkungsmechanismus der Schilddrüsenhormonrezeptoren. Hier aktivieren TRα und TRβ Signalkaskaden im Zytoplasma. Ziel dieses Projektes ist es, anhand eigens generierter Knock-In Mausmodelle die physiologische Bedeutung der nicht-kanonisch vermittelten Schilddrüsenhormonwirkung in vivo zu charakterisieren und die zugrundeliegenden molekularen Mechanismen zu entschlüsseln.
Kontakt

Univ.-Prof. Dr. med.
Lars Möller
Professur für Translationale Schilddrüsenforschung, Oberarzt und Stellvertreter der Direktorin (Forschung und Lehre)
Sie finden uns im:
MFZ und MZ
- Labor(MFZ): Raum 3.019
-84646 - Büro(MZ): Raum 2.172
-6401
Methoden
Anhand eigens generierter Knock-In Mausmodelle sind wir in der Lage die physiologische Bedeutung der nicht-klassisch vermittelten Schilddrüsenhormonwirkung in vivo zu untersuchen und zu charakterisieren. Durch Verwendung von Radiotelemetrie untersuchen wir in Echtzeit den Einfluss der Schilddrüsenhormonwirkung auf kardiometabolische Prozesse wie die Regulierung der Körpertemperatur, der Herzfrequenz und der Aktivität. Zur Aufklärung der molekularen Mechanismen der TR-Wirkung verwenden wir primäre Zellkulturen (z.B. Hepatozyten) und etablierte Zelllinien.
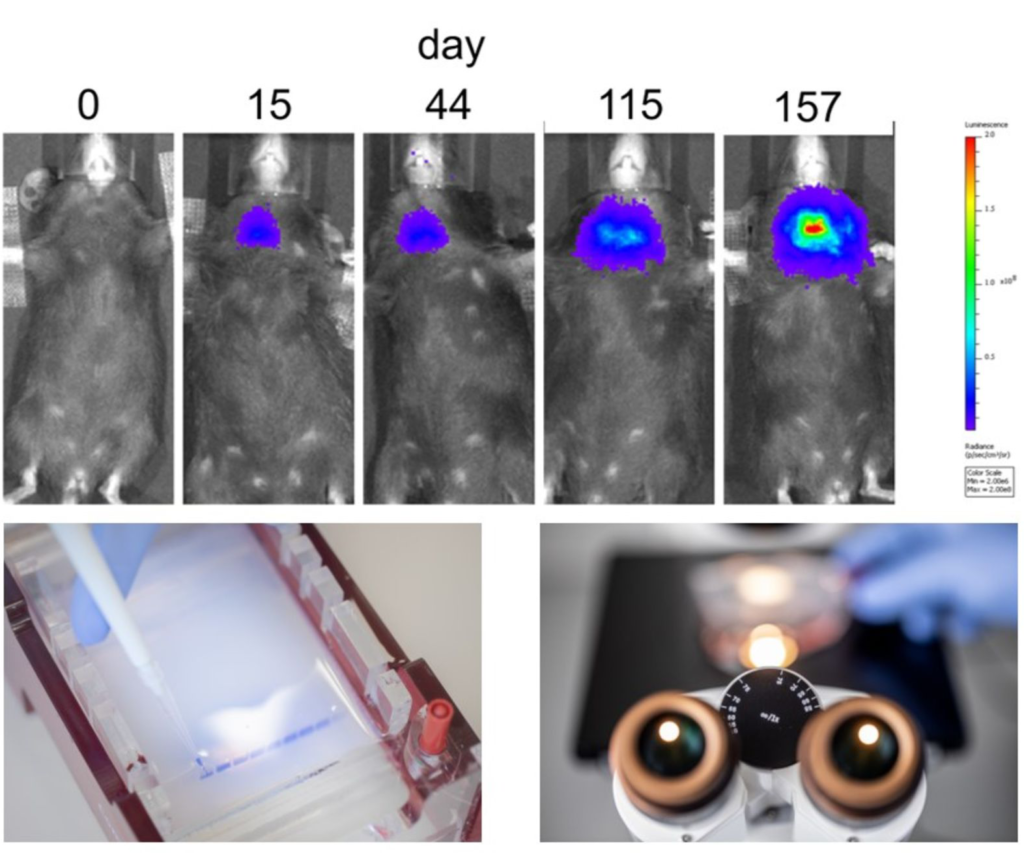
Durch Kreuzung verschiedener transgener Mausmodelle für Onkogene und Tumorsuppressorgene können wir die Entwicklung von anaplastischen Schilddrüsentumoren und die zugrundeliegenden molekularen, pathologischen Mechanismen untersuchen. Den Tumorprogress können wir mittels in vivo Imaging am lebenden Tier im Langzeitverlauf verfolgen (siehe Bild: rechte Abbildung).
Im Labor für molekulare Endokrinologie kommen Labor-Techniken wie Genexpressionanalysen (qRT-PCR und Microarrayanalysen), immunhistochemische- und immunfluoreszenz-basierte Färbungen von Gewebeschnitten, Luciferase-Reporter-Assays sowie auch Expressionsanalysen mittels Immuno-Blot und diverse molekularbiologische Methoden (z.B. Klonierungstechniken) zum Einsatz (siehe Bild; untere Abbildungen).
Noncanonical Action of Thyroid Hormone Receptors α and β.
Hönes GS, Geist D, Moeller LC.
2020. Exp Clin Endocrinol Diabetes 128(6-07):383-387. doi: 10.1055/a-1088-1187
Increased Anaplastic Lymphoma Kinase Activity Induces a Poorly Differentiated Thyroid Carcinoma in Mice.
Kohler H, Latteyer S, Hönes GS, Theurer S, Liao XH, Christoph S, Zwanziger D, Schulte JH, Kero J, Undeutsch H, Refetoff S, Schmid KW, Führer D, Moeller LC.
2019. Thyroid 29(10):1438-1446. doi: 10.1089/thy.2018.0526
Thyroxine promotes lung cancer growth in an orthotopic mouse model.
Latteyer S, Christoph S, Theurer S, Hönes GS, Schmid KW, Führer D, Moeller LC.
2019. Endocr Relat Cancer 26(6):565-574. doi: 10.1530/ERC-18-0353
Noncanonical thyroid hormone signaling mediates cardiometabolic effects in vivo.
Hönes GS, Rakov H, Logan J, Liao XH, Werbenko E, Pollard AS, Præstholm SM, Siersbæk MS, Rijntjes E, Gassen J, Latteyer S, Engels K, Strucksberg KH, Kleinbongard P, Zwanziger D, Rozman J, Gailus-Durner V, Fuchs H, Hrabě de Angelis M, Klein-Hitpass L, Köhrle J, Armstrong DL, Grøntved L, Bassett JHD, Williams GR, Refetoff S, Führer D, Moeller LC.
2017. Proc Natl Acad Sci U S A 26;114(52):E11323-E11332. doi: 10.1073/pnas.1706801115
Differential regulation of monocarboxylate transporter 8 expression in thyroid cancer and hyperthyroidism.
Badziong J, Ting S, Tiedje V, Brix K, Brabant G, Möller LC, Schmid KW, Führer D, Zwanziger D.
2017. Eur J Endocrinol 177(3):243-250. doi: 10.1530/EJE-17-0279
The long N-terminus of the human monocarboxylate transporter 8 is a target of ubiquitin-dependent proteasomal degradation which regulates protein expression and oligomerization capacity.
Zwanziger D*, Schmidt M*, Fischer J, Kleinau G, Braun D, Schweizer U, Möller LC, Biebermann H, Führer D. *equal contribution.
2017. Mol Cell Endocrinol 434:278-87. doi: 10.1016/j.mce.2016.05.017
A 6-Base Pair in Frame Germline Deletion in Exon 7 Of RET Leads to Increased RET Phosphorylation, ERK Activation, and MEN2A.
Latteyer S, Klein-Hitpass L, Khandanpour C, Zwanziger D, Poeppel TD, Schmid KW, Führer D, Moeller LC.
2016. J Clin Endocrinol Metab 101(3):1016-22. doi: 10.1210/jc.2015-2948
Sex-dependent claudin-1 expression in the liver of euthyroid and hypothyroid mice.
Zwanziger D, Rakov H, Engels K, Möller LC, Führer D.
2015. Eur Thyroid J 4(suppl1):67-73. doi: 10.1159/000431316
The impact of claudin-1 on follicular thyroid carcinoma aggressiveness.
Zwanziger D*, Badziong J*, Ting S, Möller LC, Schmid KW, Siebolts U, Wickenhauser C, Dralle H, Führer D. *equal contribution.
2015. Endocr Relat Cancer 22(5):819-30. doi: 10.1530/ERC-14-0502
